ดีโมครีตัส ( นักปราชญ์ชาวกรีก) ได้กล่าวว่าทุกสิ่งทุกอย่างประกอบขึ้นจาก อนุภาคที่เล็กมาก เล็กมากจนไม่สามารถมองเห็นได้ อนุภาคเล็กๆ เหล่านี้จะรวมพวกเข้าด้วยกันโดยวิธิการต่างๆ สำหรับอนุภาคเองนั้นไม่มีการเปลี่ยนแปลงและไม่สามารถจะแตกแยกออกเป็นชิ้นส่วนที่เล็กลงไปอีกได้ ดีโมครี- ตัสตั้งชื่ออนุภาคนี้ว่า อะตอม (Atom) จากภาษากรีกที่ว่า atoms ซึ่งมีความหมายว่า ไม่สามารถแบ่งแยกได้อีก ตามความคิดเห็นของเขา อะตอมเป็นชิ้นส่วนที่เล็กที่สุดของสสารที่สามารถจะคงอยู่ได้

ภาพการแปรียบเทียบขนาดของอะตอม
1. ทราบสมบัติทางเคมีและสมบัติการเปล่งแสงของธาตุ
2. เราสามารถศึกษาแกแล็กซี่ (galaxy) ดวงดาวและดาวเคราะห์ต่างๆ
โดยพิจารณาจากการศึกษาสเปกตรัมที่ได้จากดวงดาว
แบบจำลองอะตอมของจอห์นดอลตัน
จอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมโดยอาศัยข้อมูลจากการทดลองที่พอจะศึกษาได้และนับว่าเป็นทฤษฎีแรกที่เกี่ยวกับอะตอมที่พอจะเชื่อถือได้ ซึ่งมีใจความดังนี้
จากทฤษฎีอะตอมของดาลตัน แบบจำลองอะตอมมีลักษณะดังรูป

ลักษณะแบบจำลองอะตอมของดอลตัน
( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4
ใช้ไม่ได้ในปัจจุบัน)
ข้อ 1. อะตอมไม่ใช่สิ่งที่เล็กที่สุด
อะตอมยังประกอบด้วยอนุภาคอิเล็กตรอน, โปรตอน, นิวตรอน เป็นต้น
ข้อ 3 - 4
อะตอมของธาตุชนิดเดียวกันมีคุณสมบัติทางกายภาพไม่เหมือนกัน กล่าวคือมีมวลไม่เท่ากัน
ซึ่งจะได้กล่าวต่อไป ในเรื่อง " ไอโซโทรป"
จากผลการทดลองของทอมสัน โกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้นเขาจึงเสนอแบบจำลองอะตอมว่า
จากทฤษฎีอะตอมของทอมสัน แบบจำลองอะตอมมีลักษณะดังรูป
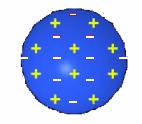
ลักษณะแบบจำลองอะตอมของทอมสัน
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมจะประกอบด้วยนิวเคลียสที่มีโปรตอนและนิวตรอนรวมตัวกันอยู่อย่างหนาแน่นอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากมีมวลมาก และมีประจุบวกส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบและมีมวลน้อยมาก จะวิ่งรอบนิวเคลียสเป็นวงกว้าง การค้นพบนิวตรอน เนื่องจากมวลของอะตอมส่วนใหญ่อยู่ที่นิวเคลียสซึ่งเป็นมวลของโปรตอนแต่โปรตอนมีมวลประมาณครึ่งหนึ่งของนิวเคลียสเท่านั้น แสดงว่าต้องมีอนุภาคซึ่งไม่มีประจุไฟฟ้าแต่มีมวลใกล้เคียงกับโปรตอนอยู่ในอะตอมด้วย เจมส์ แชวิก นักวิทยาศาสตร์ชาวอังกฤษ จึงศึกษาทดลองเพิ่มเติมจนพบนิวตรอนซึ่งเป็นกลางทางไฟฟ้า อะตอมของธาตุทุกชนิดในโลกจะมีนิวตรอนเสมอ ยกเว้นอะตอมของไฮโดรเจนในรูปของไอโซโทป
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
จากทฤษฎีอะตอมของ รัทเทอร์ฟอร์ด แบบจำลองอะตอมมีลักษณะดังรูป
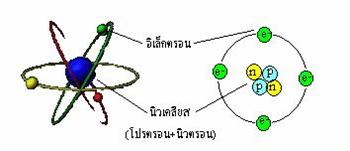
ลักษณะแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
แบบจำลองอะตอมของนีลส์โบร์
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา
สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน
และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2.
อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น
ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n =
1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,...
ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O
, P , Q ....
จากทฤษฎีอะตอมของ นีลส์โบร์ แบบจำลองอะตอมมีลักษณะดังรูป
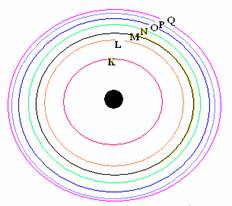
ลักษณะแบบจำลองอะตอมของนีลส์โบร์
แบบจำลองอะตอมแบบกลุ่มหมอก
เป็นแบบจำลองที่นักวิทยาศาสตร์คิดว่าเป็นไปได้มากที่สุดทั้งนี้ได้จากการประมวลผลการทดลองและข้อมูลต่างๆ
อะตอมภายหลังจากที่นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา
อาจสรุปได้ดังนี้
1. อิเล็กตรอนไม่สามารถวิ่งรอบนิวเคลียสด้วยรัศมีที่แน่นอน
บางครั้งเข้าใกล้บางครั้งออกห่าง จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้
แต่ถ้าบอกได้แต่เพียงที่พบอิเล็กตรอนตำแหน่งต่างๆภายในอะตอมและอิเล็กตรอนที่เคลื่อนที่เร็วมากจนเหมือนกับอิเล็กตรอนอยู่ทั่วไป
ในอะตอมลักษณะนี้เรียกว่า " กลุ่มหมอก"
2.
กลุ่มหมอกของอิเล็กตรอนในระดับพลังงานต่างๆจะมีรูปทรงต่างกันขึ้นอยู่กับจำนวนอิเล็กตรอน
และระดับพลังงานอิเล็กตรอน
3.
กลุ่มหมอกที่มีอิเล็กตรอนระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียสส่วนอิเล็กตรอนที่มีระดับพลังงานสูงจะอยู่ไกลนิวเคลียส
4. อิเล็กตรอนแต่ละตัวไม่ได้อยู่ในระดับพลังงานใดพลังงานหนึ่งคงที่
5. อะตอมมีอิเล็กตรอนหลายๆระดับพลังงาน
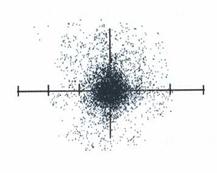
ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอก
สรุปแบบจำลองอะตอม

อนุภาคมูลฐานของอะตอม
ชนิดของอนุภาคมูลฐานของอะตอม
ทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
|
อนุภาค |
ประจุ ( หน่วย) |
ประจุ (C) |
มวล (g) |
มวล (amu) |
|
อิเล็กตรอน |
-1 |
1.6 x 10 -19 |
0.000549 |
9.1096 x 10 -28 |
|
โปรตอน |
+1 |
1.6 x 10 -19 |
1.007277 |
1.6726 x 10 -24 |
|
นิวตรอน |
0 |
0 |
1.008665 |
1.6749 x 10 -24 |
' อิเล็กตรอน (Electron) สัญลักษณ์ e - มีแระจุลบ และมีมวลน้อยมาก
' โปรตอน สัญลักษณ์ p + มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน ( เกือบ 2,000 เท่า)
' นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆ กับโปรตอน
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม (atomic number,
Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล (mass
number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
( เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
ไอโซโทป ( Isotope ) หมายถึง
อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน เช่น
![]()
![]()
![]()
ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน
แต่มีเลขอะตอมไม่เท่ากัน เช่น ![]()
![]()
ไอโซโทน ( Isotone ) หมายถึง
อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน เช่น ![]()
![]()
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์
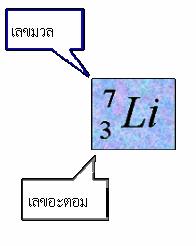
ดังนั้น อะตอมของธาตุลิเทียม ( Li )
มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
การจัดเรียงอิเล็กตรอน
1. อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน
ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด
และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ
พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P
< Q
หรือชั้นที่ 1< 2 < 3 < 4 < 5 < 6 < 7

แบบจำลองอะตอมของนีลส์โบร์
2. ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2 เมื่อ n = เลขชั้น ซึ่งเลขชั้นของชั้น K=1,L=2,M=3,N=4,O=5,P=6 และ Q=7
ตัวอย่าง จำนวน e - ในระดับพลังงานชั้น K
มีได้ ไม่เกิน 2n 2 = 2 x 1 2 = 2x1 =
2
จำนวน e - ในระดับพลังงานชั้น N มีได้ ไม่เกิน 2n 2 = 2 x 4 2 = 2x16 = 32
|
ระดับพลังงาน |
จำนวนอิเล็กตรอนที่มีได้มากที่สุด |
n = 1 (K) |
2(1) 2 = 2 |
n = 2 (L) |
2(2) 2 = 8 |
n = 3 (M) |
2(3) 2 = 18 |
n = 4 (N) |
2(4) 2 = 32 |
n = 5 (O) |
2(5) 2 = 32 ( 32 คือ เลขมากสุดที่เป็นไปได้ ) |
n = 6 (P) |
2(6) 2 = 32 |
n = 7 (Q) |
2(7) 2 = 32 |
จะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้
อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
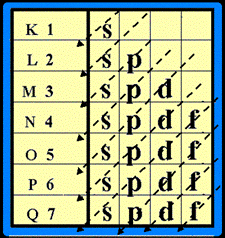
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย
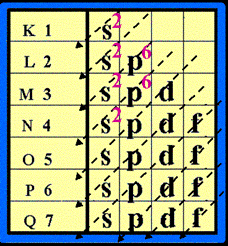
และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ในแต่ละชั้นย่อย จะมีจำนวน e - ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e - ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e - ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e - ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
การจัดเรียงอิเล็กตรอน ให้จัดเรียง e- ในระดับพลังงานชั้นย่อยโดยจัดเรียงลำดับตามลูกศร ( แนวทางการจัดเรียงอิเล็กตรอน ให้เขียนแผนผังก่อน ดังรูป

จัดเรียงอิเล็กตรอนตามลูกศร ดังรูป
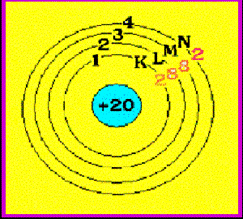
ตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม ( Ca )
ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว ( ดูเลขอะตอม
จากตารางธาตุ)
แล้วจัดเรียง e- ดังนี้
ดังนั้น การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2
มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว
จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (Valence
electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป