ธาตุและสารประกอบ
ในภาวะปกติ ธาตุบางชนิดดำรงอยู่สถานะของแข็ง บางชนิดเป็นของเหลว และบางชนิดเป็นก๊าซ เราแบ่งธาตุทั้งหมดออกได้เป็นสามพวกใหญ่ ๆ คือ โลหะ อโลหะ และกึ่งโลหะ ตัวอย่าง โลหะและอโลหะที่เราพอรู้จักกันคือ
|
โลหะ |
อโลหะ | ||
|
ทองคำ |
( ของแข็ง) |
ไฮโดรเจน |
( ก๊าซ) |
สมบัติอื่น ๆ บางประการของธาตุบางชนิด
|
ธาตุ |
ความมันวาว |
การนำความร้อน |
การนำไฟฟ้า |
ความเหนียว |
|
Al |
เป็นมันวาว |
นำได้ดี |
นำได้ดี |
เหนียว |
|
Mg |
เป็นมันวาว |
นำได้ดี |
นำได้ดี |
เหนียว |
|
C( แกรไฟต์) |
ไม่มันวาว |
นำได้ดี |
นำได้ดี |
เปราะ |
|
S |
ไม่มันวาว |
ไม่นำ |
ไม่นำ |
เปราะ |
|
P |
ไม่มันวาว |
ไม่นำ |
ไม่นำ |
เปราะ |
การที่เราจำแนกธาตุทั้งหลายออกเป็นโลหะกับอโลหะ ก็เนื่องจากธาตุต่าง ๆ แม้จะมีสมบัติเฉพาะตัวแตกต่างกัน แต่ก็มีสมบัติบางประการเหมือนกันหรือคล้ายกัน พอจะแยกออกได้เป็น 2 พวก คือ
ตาราง การเปรียบเทียบสมบัติของโลหะและอโลหะ
|
สมบัติ |
โลหะ |
อโลหะ |
|
1. สถานะ |
เป็นของแข็งในสภาวะปกติ ยกเว้นปรอทซึ่งเป็นของเหลว |
มีอยู่ได้ทั้ง 3 สถานะ ธาตุที่เป็นก๊าซในภาวะปกติเป็นอะโลหะ |
|
2. ความมันวาว |
มีวาวโลหะ ขัดขึ้นเงาได้ |
ส่วนมากไม่มีวาวโลหะ ยกเว้น แกรไฟต์ และเกล็ดไอโอดีน |
|
3. การนำไฟฟ้าและน้ำความร้อน |
นำไฟฟ้าและนำความร้อนได้ดี เช่น สายๆฟฟ้ามักทำด้วยทองแดง |
นำไฟฟ้าและนำความร้อนไม่ได้ยกเว้นแกรไฟต์ นำไฟฟ้าได้ดี |
|
4. ความเหนียว |
ส่วนมากเหนียว ดึงยืดเป็นเส้นลวด หรือตีเป็นแผ่นบ่าง ๆ ได้ |
อโลหะที่เป็นของแข็ง มีเปราะดึงยืดออกเป็นเส้นลวดหรือตีเป็นแผ่นบาง ๆ ไม่ได้ |
|
5. ความหนาแน่น หรือความถ่วงจำเพาะ (ถ. พ. ) |
ส่วนมากมีความหนาแน่น หรือ ถ . พ. สูง |
มีความหนาแน่น หรือ ถ . พ. ต่ำ |
|
6. จุดเดือนและจุดหลอดเหลว |
ส่วนมากสูงเช่น เหล็ก มีจุดหลอดเหลว 1,536 OC จุดเดือด 3,000 OC ยกเว้นปรอท ซึ่งมีจุดหลอดเหลวต่ำเพียง -39 OC |
ส่วนมากต่ำโดยเฉพาะพวกอโลหะที่เป็นก๊าซ เช่น ออกซิเจน มีจุดเดือด -183 OC จุดเยือกแข็ง ( จุดหลอดเหลว) -219 OC กำมะถันมีจุดหลอดเหลว 113 OC จุดเดือด 444 OC เป็นต้น |
|
7. การเกิดเสียงเมื่อเคาะ |
มีเสียงดังกังวาน |
ไม่มีเสียงดังกังวาน |
|
8. เกี่ยวกับอิเล็กตรอนและประจุไอออน |
เป็นพวกชอบให้อิเล็กตรอน ทำให้เกิดเป็นไอออนบวก |
เป็นพวกชอบรับอิเล็กตรอน ทำให้เกิดเป็นไอออนลบ |
|
9. การ เกิดสารประกอบ |
เกิดสารประกอบ เช่น ออกไซด์ คลอไรด์ ซัลไฟด์ และไฮไดร์ได้ |
เกิดสารประกอบ เช่น ออกไซด์ คลอไรด์ ซัลไฟด์ และไฮไดร์ได้ |
|
10. สารประกอบออกไซด์ |
โลหะออกไซด์เป็นเบส |
อโลหะออกไซด์เป็นกรด |
ส่วนพวกกึ่งโลหะ หมายถึง ธาตุที่มีสมบัติกึ่งโลหะและอโลหะ เช่น ธาตุซิลิคอน มีสมบัติบางประการคล้ายโลหะ เช่น นำไฟฟ้าได้บ้างที่อุณหภูมิปกติ และนำไฟฟ้าได้มากขึ้นเมื่ออุณหภูมิเพิ่มขึ้น เป็นของแข็ง เป็นมันวาวสีเงิน จุดเดือดสูง แต่เปราะแตกง่าย คล้ายอโลหะ
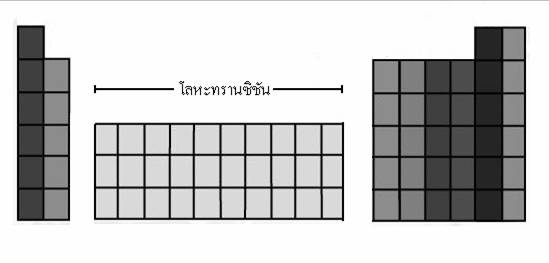
โลหะทรานซิชัน
โลหะทรานซิชันบรรจุไว้ตรงกลางของตารางธาตุ โลหะทรานซิชันที่รู้จักกันดี คือ เหล็ก ทองแดง สังกะสี โครเมียม นิกเกิล และทองคำ โลหะทรานซิชัน มีทั้งหมด 8 หมู่ แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ ดังรูป

สมบัติทางกายภาพ
สมบัติทางเคมี
ธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี หมายถึง ธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82
กัมมันตภาพรังสี หมายถึง ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีเบต้า และรังสีแกมมา
ในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่งมีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
![]()
(ธาตุยูเรเนียม)............. (ธาตุทอเลียม) (อนุภาคแอลฟา)
จะเห็นได้ว่าการแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน โดย มวลจำนวนหนึ่งของธาตุ จะลดลงเหลือครึ่งหนึ่งของมันที่มีอยู่เดิม เมื่อเวลาผ่านไป เรียกว่า ครึ่งชีวิตของธาตุ ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปและสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้
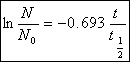
สูตรคำนวณหา ครึ่งชีวิตของธาตุ
กำหนดให้ N คือ มวลของธาตุที่เหลืออยู่
N 0 คือ มวลของธาตุที่มีอยู่เดิม
t คือ เวลาที่ผ่านไปที่เกิดการสลายตัว
t 0 คือ เวลา ครึ่งชีวิตของแต่ละธาตุ
รังสีที่ทำให้เกิดการแตกของประจุ ( Ionizing Radiation )
ประเภทของปฏิกิริยานิวเคลียร์
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ
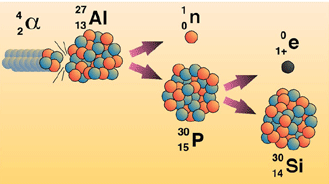
1. ปฏิกิริยาฟิวชัน (Fussion reaction) คือ ปฏิกิริยานิวเคลียร์ที่นิวเคลียสของธาตุเบาหลอมรวมกันเข้าเป็นนิวเคลียสที่หนักกว่า และมีการคายความร้อนออกมาจำนวนมหาศาลและมากกว่าปฏิกิริยาฟิชชันเสียอีก ดังภาพ ปฏิกิริยาฟิวชันที่รู้จักกันดี คือ ปฏิกิริยาระเบิดไฮโดรเจน (Hydrogen bomb)
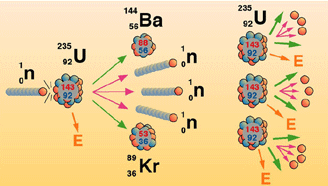
2. ปฏิกิริยาฟิชชัน (Fission reaction) คือปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ดังภาพ ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรง นักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณู ซึ่งสามารถนำไปใช้ผลิตกระแสไฟฟ้าได้
ประโยชน์ของธาตุกัมมันตรังสี
1. ทำเตาปฏิกรณ์ปรมาณู ทำโรงงานไฟฟ้าพลังงานปรมาณู และเรือดำน้ำปรมาณู
2. ใช้สร้างธาตุใหม่หลังยูเรเนียม สร้างขึ้นโดยยิ่งนิวเคลียสของธาตุหนักด้วยอนุภาคแอลฟา หรือด้วยนิวเคลียสอื่นๆ ที่ค่อนข้างหนัก และมีพลังงานสูง
3. ใช้ศึกษากลไกของปฏิกิริยาเคมี เช่น การเกิดปฏิกิริยาของเอสเทอร์
4. ใช้ในการหาปริมาณวิเคราะห์
5. ใช้ในการหาอายุของซากสิ่งมีชีวิต (C - 14)
6. การรักษาโรค เช่น มะเร็ง (Ra - 226)
7. ใช้ในการถนอมอาหารให้อยู่ได้นานๆ ( Co-60)
8. ใช้ ศึกษาความต้องการปุ๋ยของพืช และปรับปรุงเมล็ดพันธุ์ที่ต้องการ (P - 32)
โทษของธาตุกัมมันตรังสี
ถ้าร่างกายได้รับจะทำให้โมเลกุลภายในเซลล์เกิดการเปลี่ยนแปลงไม่สามารถทำงานตามปกติได้ ถ้าเป็นเซลล์ที่เกี่ยวข้องกับการถ่ายทอดลักษณะพันธุกรรมก็จะเกิดการผ่าเหล่า โดยเฉพาะเซลล์สืบพันธุ์ เมื่อเข้าไปในร่างกายจะไปสะสมในกระดูก ส่วนผลที่ทำให้เกิดความป่วยไข้จากรังสี เมื่ออวัยวะส่วนใดส่วนหนึ่งของร่างกายได้รับรังสี โมเลกุลของธาตุต่างๆ ที่ประกอบเป็นเซลล์จะแตกตัว ทำให้เกิดอาการป่วยไข้และเกิดมะเร็งได้
ตารางแสดง ธาตุไอโซโทป
|
ธาตุ/ไอโซโทป |
ครึ่งชีวิต |
แบบการสลายตัว |
ประโยชน์ |
|
Tc -99 |
6 ชั่วโมง |
- |
- |
|
C-14 |
5,760 ปี |
เบต้า |
หาอายุวัตถุโบราณ |
|
Co-60 |
5.26 ปี |
แกมมา |
รักษามะเร็ง |
|
Au-198 |
2.7 วัน |
เบต้า แกมมา |
วินิจฉัยตับ |
|
I-125 |
60 วัน |
แกมมา |
หาปริมาณเลือด |
|
I-131 |
8.07 วัน |
เบตา แกมมา |
วินิจฉัยอวัยวะ |
|
P-32 |
14.3 วัน |
เบต้า |
รักษามะเร็ง |
|
Pu-239 |
24,000 ปี |
อัลฟา แกมมา |
พลังงาน |
|
K-40 |
1 x10 9 ปี |
เบต้า |
หาอายุหิน |
|
U-238 |
4.5x10 9 ปี |
อัลฟา แกมมา |
วัตถุเริมต้นให้ Pu-239 |
|
U-235 |
7.1x10 9 ปี |
อัลฟา แกมมา |
รักษามะเร็ง |
|
Cl-36 |
4x10 5 ปี |
- |
- |
|
Po-216 |
0.16 วินาที |
- |
- |
|
Ra-226 |
1,600 ปี |
อัลฟา แกมมา |
รักษามะเร็ง |
|
Na-24 |
15 ชั่วโมง |
- |
- |
ตารางแสดง ปริมาณและผลของรังสี
|
ปริมาณรังสีที่รับ |
ผลของรังสีที่ได้รับต่อสุขภาพ |
|
4 มิลลิเร็ม |
เดินทางไปกลับด้วยเครื่องบิน นิวยอร์ค-ลอนดอน |
|
20 มิลลิเร็ม |
x -ray ปอด 1 ครั้ง |
|
30-50 มิลลิเร็ม/ต่อปี |
อยู่ในบ้านไม้ |
|
50-100 มิลลิเร็ม/ต่อปี |
อยู่ในบ้านอิฐ |
|
70-100 มิลลิเร็ม/ต่อปี |
อยู่ในบ้านปูน(คอนกรีต) |
|
170 มิลลิเร็ม/ต่อปี |
ตายด้วยโรคมะเร็ง 1 ใน 250,000 คน |
|
500 มิลลิเร็ม/ต่อปี |
ค่ามาตรฐานที่นานาชาติยอมรับได้สำหรับประชาชน ทั่ว ๆไป |
|
5000 มิลลิเร็ม/ต่อปี |
ค่ามาตรฐานที่นานาชาติยอมรับได้สำหรับเจ้าหน้าที่ใน อุตสาหกรรมนิวเคลียร์ |
|
25 เร็ม |
มีเลือดขาวต่ำกว่าปกติเล็กน้อย |
|
50 เร็ม |
เกิดมีรอยแผลของผิวหนัง เม็ดเลือดขาวต่ำชัดเจนขึ้น |
|
100 เร็ม |
คลื่นไส้อาเจียนผมร่วงมีอัตราการเสี่ยงต่อโรคมะเร็งในระยะยาว |
|
200-600 เร็ม |
เลือดขาวต่ำอย่างรุนแรง มีเลือดออกในร่างกาย มีโอกาสเสียชีวิต 50 % |
|
600-1000 เร็ม |
เม็ดเลือดขาวถูกทำลายโดยสิ้นเชิง ระบบทำงานของลำไส้ถูกทำลาย มีโอกาสเสียชีวิต 80-100% |
|
มากกว่า 1000 เร็ม |
เสียชีวิตใน 1-14 วัน |
การจัดตำแหน่งไฮโดรเจนในตารางธาตุ
การจัดธาตุให้อยุ่ในหมู่ใดของตารางธาตุจะใช้สมบัติที่คล้ายกันเป็นเกณฑ์ ในตารางธาตุปัจจุบันได้จัดให้ธาตุไฮโดรเจนอยู่ในคาบที่ 1 ระหว่างหมู่ 1 กับหมู่ 7 เพราะเหตุใดจึงเป็นเช่นนั้น ให้ศึกษาสมบัติบางประการของธาตุไฮโดรเจนเปรียบเทียบกับสมบัติธาตุหมู่ 1 และหมู่ 7
ตารางสมบัติของประการของธาตุไฮโดรเจนกับธาตุหมู1 กับหมู่ 7
|
สมบัติ |
ธาตุหมู่ 1 |
ธาตุไฮโดรเจน |
ธาตุหมู่ 7 |
| จำนวนเวเลนต์อิเล็กตรอน | 1 |
1 |
7 |
| เลขออกซิเดซันในสารประกอบ | +1 |
+1 และ -1 |
+1 +3 +5 +7 – 1 |
| ค่า IE | 382-526 |
1318 |
1015 – 1687 |
| อิเล็กโทรเนกาทิวิตี | 1.0-0.7 |
2.1 |
1015 – 1687 |
| สถานะ | ของแข็ง |
ก๊าซ |
ก๊าซ /ของเหลว/ของแข็ง |
| การนำฟ้า | นำ |
ไม่นำ |
ไม่นำ |
เมื่อพิจารณาข้อมูลในตาราง พบว่าไฮโดรเจนมีเวเลนซ์อิเล็กตรอน 1 และมีเลขออกซิเดชัน +1 ไฮโดรเจนจึงควรอยู่ในหมู่ 1 คาบที่ 1 แต่ไฮโดรเจนมีสมบัติคล้ายธาตุหมู่ 7 หลายประการคือ มีเลขออกซิเดชันได้มากกว่าหนึ่งค่า มีพลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีสูง มีสถานะเป็นก๊าซ ไม่นำไฟฟ้า เมื่อเกิดเป็นสารประกอบต้องการเพียง 1 อิเล็กตรอนก็จะมีการจัดอิเล็กตรอนเช่นเดียวกับฮีเลียมซึ่งเป็นธาตุในหมู่ 7 คาบที่ 1 อยู่ระหว่างหมู่ 1 กับ 7 ดังปรากฏในตารางธาตุ
สารประกอบออกไซด์
สารประกอบออกไซด ์ หมายถึง สารประกอบที่เกิดจากธาตุออกซิเจนรวมกับธาตุอื่น ๆ ซึ่งอาจจะเป็นโลหะหรืออโลหะก็ได้ เช่น Na 2O, P 2O 3, NO 2
การเตรียมสารประกอบออกไซด์ อาจจะทำได้โดยนำออกซิเจนมาเผารวมกับธาตุต่าง ๆ เช่น
4Na (s) + O 2 (g) --------------> 2Na 2O (s)
2Ca(s) + O 2 (g) --------------> 2CaO (s)
4Al(s) + O 2 (g) ---------------> 2Al 2O 3 (s)
C(s) + O 2 (g) --------------> CO 2 (g)
สมบัติบางประการของสารประกอบออกไซด ์
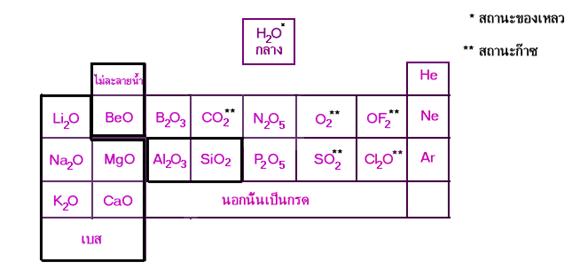
จากการศึกษาสมบัติบางประการของสารประกอบออกไซด์ของ 20 ธาตุแรก เกี่ยวกับสูตรของสารประกอบ จุดหลอมเหลว สถานะ การละลายน้ำ และความเป็นกรด - เบสของสารละลายได้ผลสรุปดังนี้
1. เมื่อใช้ความเป็นโลหะและอโลหะเป็นเกณฑ์ จะแบ่งสารออกได้เป็น 2 กลุ่มดังนี้
ก . ออกไซด์ของโลหะ เช่น Li 2O BeO Na 2O MgO Al 2O 3 K 2O CaO
ข . ออกไซด์ของอโลหะ เช่น H 2O CO 2 N 2O 5 F 2O P 2O 5 SO 2 Cl 2O
2. การแบ่งกลุ่มย่อยอาจจะใช้สมบัติความเป็นกรด - เบสของสารละลาย เช่น
ก . ออกไซด์ของโลหะ
- สารละลายเป็นกรด -
- สารละลายเป็นเบส ได้แก่ Li 2O Na 2O MgO K 2O และ CaO
- สารละลายเป็นกลาง ได้แก่ -
- พวกไม่ละลายน้ำ ได้แก่ BeO Al 2O 3 B 2O 3 SiO 2ข . ออกไซด์ของอโลหะ
- สารละลายเป็นกรด ได้แก่ CO 2 N 2O 5 F 2O P 2O 5 SO 2 และ Cl 2O
- สารละลายเป็นเบส ได้แก่ -
- สารละลายเป็นกลาง ได้แก่ H 2O
- พวกไม่ละลายน้ำ ได้แก่ -
4. เมื่อใช้จุดหลอมเหลวเป็นเกณฑ์จะได้กลุ่มย่อยดังนี้
|
ออกไซด์ที่เป็นของแข็ง |
ออกไซด์ที่เป็นของแข็งและ |
ออกไซด์ที่เป็นของเหลวหรือ | |||
|
สูตร |
จุดหลอมเหลว (0C) |
สูตร |
จุดหลอมเหลว (0C) |
สูตร |
จุดหลอมเหลว (0C) |
|
Li 2O |
1700 |
K 2O |
350 |
H 2O(l) |
0 |
|
Na 2O |
1275 |
B 2O 3 |
460 |
CO 2(g) |
-57 |
|
BeO |
2530 |
P 2O 5 |
580 |
N 2O 5(g) |
-102 |
|
MgO |
2800 |
- |
- |
F 2O(g) |
-218 |
|
CaO |
2580 |
- |
- |
P 2O 5(g) |
-224 |
|
Al 2O 3 |
2045 |
- |
- |
SO 2(g) |
-73 |
|
- |
- |
- |
- |
Cl 2O(g) |
-20 |
ก . ออกไซด์ของโลหะ มีสถานะเป็นของแข็งที่มีจุดหลอมเหลวค่อนข้างสูง
พวกที่ละลายน้ำได้สารละลายจะแสดงสมบัติเป็นเบส
เปลี่ยนสีกระดาษลิตมัสจากแดงเป็นน้ำเงิน
ข . ออกไซด์ของอโลหะ มีสถานะเป็นได้ทั้งของแข็ง ของเหลวและก๊าซ
ส่วนมากมีจุดหลอมเหลวค่อนข้างต่ำพวกที่ละลายน้ำได้สารละลายจะแสดงสมบัติเป็นกรด
เมื่อนำสารประกอบออกไซด์มาจัดเรียงเป็นหมวดหมู่เดียวกันตามตารางธาตุ จะได้ดังนี้
สารประกอบคลอไรด์
สารประกอบคลอไรด์ หมายถึง สารประกอบธาตุคู่ระหว่างธาตุคลอรีนกับธาตุอื่นๆ เช่น NaCl CaCl 2 HCl และ CCl 4 เป็นต้น
สารประกอบคลอไรด์สามารถเตรียมได้โดยตรง โดยผ่านก๊าซคลอรีนแห้งไปบนธาตุที่กำลังร้อน ดังนั้นในขั้นแรกจึงต้องเตรียมก๊าซคลอรีนก่อนแล้วจึงผ่านก๊าซคลอรีนที่ได้นั้นลงไปบนธาตุที่ร้อนดังกล่าว
การเตรียมก๊าซคลอรีนในห้องปฏิบัติการ ใช้ปฏิกิริยาระหว่างโปตัสเซียมเพอร์แมงกาเนต (KMnO 4) กับก๊าซไฮโดรคลอริก(HCl) เข้มข้นประมาณ 10 mol/dm 3 ซึ่งเกิดปฏิกิริยาต่อไปนี้
KMnO 4 (s) + 16 HCl (aq) -----> 2KCl (aq) + 2MnCl 2 (aq) + 8H 2 (l) + 5Cl 2 (g)
หมายเหตุ ก๊าซคลอรีนเป็นก๊าซพิษ ดังนั้นการเตรียมจึงต้องทำอย่างระมัดระวัง
สมบัติของสารประกอบคลอไรด์
1. การแตกตัวเป็นไอออนทดสอบได้โดยใช้สารละลาย AgNO 3 ซึ่งถ้ามีCl - จะเกิดตะกอนของ AgCl จัดว่าเป็นวิธีทดสอบคลอไรด์ไอออนวิธีหนึ่ง จากสมการดังต่อไปนี้
Ag +(aq) + Cl - (aq) -------> AgCl (s)
2. แบ่งสารประกอบคลอไรด์ออกเป็น 2 กลุ่มใหญ่ๆ คือ คลอไรด์ของโลหะและคลอไรด์ของอโลหะดังนี้
ก . คลอไรด์ของโลหะ ได้แก่ LiCl BeCl 2 NaCl MgCl 2 AlCl 3 KCl และ CaCl 2
ข . คลอไรด์ของอโลหะ ได้แก่ HCl BCl 3 CCl 4 NCl 3 Cl 2O ClF PCl 5 SiCl 4 และ SCl 2
3. เมื่อใช้ความเป็นกรด - เบสของสารละลาย จะแบ่งกลุ่มย่อยได้ดังนี้
ก . คลอไรด์ของโลหะ
- สารละลายเป็นกรด ได้แก่ AlCl 3 BeCl 2
- สารละลายเป็นกลาง ได้แก่ LiCl NaCl MgCl 2 KCl และ CaCl 2
- สารละลายเป็นเบส -ข . คลอไรด์ของอโลหะ
- สารละลายเป็นกรด ได้แก่ HCl BCl 3 Cl 2O ClF PCl 5 SiCl 4 และ SCl 2
- สารละลายเป็นกลาง ได้แก่ -
- สารละลายเป็นเบส ได้แก่ -
4. เมื่อใช้สถานะและจุดหลอมเหลว จะแบ่งกลุ่มย่อยได้ดังในตาราง
|
คลอไรด์ที่เป็นของแข็ง |
คลอไรด์ที่เป็นของแข็งและ |
คลอไรด์ที่เป็นของเหลวหรือก๊าซ | |||
|
สูตร |
จุดหลอมเหลว ( 0C) |
สูตร |
จุดหลอมเหลว ( 0C) |
สูตร |
จุดหลอมเหลว ( 0C) |
|
LiCl |
610 |
AlCl 3 |
198 |
SCl 2 |
-80 |
|
NaCl |
801 |
PCl 5 |
148 |
CCl 4 |
-23 |
|
KCl |
770 |
- |
- |
ClF |
-154 |
|
BeCl 2 |
405 |
- |
- |
Cl 2O |
-20 |
|
MgCl 2 |
712 |
- |
- |
BCl 3 |
-107 |
|
CaCl 2 |
772 |
- |
- |
NCl 3 |
-27 |
|
- |
- |
- |
- |
SiCl 4 |
-68 |
|
- |
- |
- |
- |
HCl |
-114 |
เมื่อนำคลอไรด์มาจัดรวมกันเป็นหมวดหมู่ หมวดหมู่เดียวกันตามตารางธาตุ จะได้ดังนี้

ธาตุและสารประกอบในชีวิตประจำวัน
1. โซเดียมคลอไรด์ ( NaCl ) ใช้ปรุงรสอาหาร ถนอมอาหาร เป็นสารตั้งต้นในการผลิตโซเดียมไฮโดรเจนคาร์บอเนต (NaHCO 3 ) หรือโซดาทำขนม โซเดียมคาร์บอเนต (NaCO 3 ) หรือโซดาแอส โซเดียมไฮดรอกไซด์ (NaOH ) หรือโซดาไฟ และไฮโดรเจนคลอไรด์ (HCl ) ในต่างประเทศใช้ NaCl สำหรับละลายน้ำแข็งในหิมะ เป็นสารจำเป็นในร่างกาย คือ Na + เป็นส่วนประกอบของของเหลวในร่างกาย
2. แคลเซียมคลอไรด์ ( CaCl 2 ) ใช้เป็นสารดูดความชื้น ใช้ในเครื่องทำความเย็นในอุตสาหกรรมห้องเย็น ใช้ทำฝนเทียม
3. โพแทสเซี่ยมคลอไรด์ ( KCl ) ใช้ทำปุ๋ย
4. แอมโมเนียมคลอไรด์ ( NH 4Cl ) ใช้เป็นน้ำประสารดีบุก ใช้เป็นอิเล็กโทรไลต์เซลล์ถ่านไฟฉาย
5. โซเดียมหรือแคลเซียมคลอเรต ( NaClO 3 , Ca (ClO 3 ) 2 ใช้เป็นสารฟอกสี ฟอกขาวเยื่อกระดาษ ใช้ฆ่าแบคทีเรีย และสาหร่ายในน้ำประปา และในน้ำสระ
6. HCl ใช้กำจัดสนิมเหล็กก่อนที่จะฉาบสารกันสนิม
7. DDT ใช้เป็นยาฆ่าแมลง (ปัจจุบันเป็นสารต้องห้าม)
8. ฟรีออน หรือสาร CFC ใช้ทำความเย็น เป็นตัวขับดันในกระป๋องสเปรย์
9. โบรโมคลอโรไดฟลูออโรมีเทน ( BFC ) เป็นสารที่ใช้ดับเพลิงในรถยนต์ และเครื่องบิน
10. แคลเซียม ( Ca ) เป็นธาตุหมู่ 2 มีความแข็งแรงพอใช้เป็นโลหะที่มีเงาวาว เบา ถ้าถูกับไอน้ำในอากาศมันจะหมดเงาทันที ทำปฏิกิริยากับน้ำได้ไฮโดรเจน
11. แคลเซียมคาร์บอเนต ( CaCO 3 ) พบมากในธรรมชาติเกิดอยู่ในแบบของ Limestone Marble ชอล์ก หอย เปลือกหอยกาบ และไข่มุก CaCO 3 ที่บริสุทธิ์ จะมีสีขาว CaCO 3 ที่อยู่ในรูปแบบของ Marble ใช้ประโยชน์ในการก่อสร้าง แต่ถ้าอยู่ในรูป Limestone ผสม Clay แล้วให้ความร้อนจะให้ซีเมนต์
12. แคลเซียมฟอสเฟต [ Ca 3 (PO 4 ) 2] พบมากในมลรัฐฟลอริดา อยู่ในกระดูก มีประโยชน์ใช้ทำปุ๋ยซึ่งอยู่ในรูป Super phosphate
13. แคลเซียมซัลเฟต ( CaSO 4 .2H 2O ) มีอยู่ในธรรมชาติในชื่อ ยิปซัม ใช้ในการกสิกรรมเพื่อทำให้ดินดี และยังใช้ในอุตสาหกรรมทำปูนปลาสเตอร์
14. อะลูมิเนียม ( Al ) เป็นธาตุที่มีมากเป็นที่ 3 ในโลก ผู้พบอะลูมิเนียมเป็นคนแรกคือ Hans Christan Oersted อะลูมิเนียมเป็นโลหะที่สำคัญมากและยังราคาถูก ในอุตสาหกรรมใช้อะลูมิเนียมมากที่สุด โดยการผสมกับธาตุอื่นเป็นโลหะผสม (Alloys ) สารประกอบอะลูมิเนียม ได้แก่ อะลูมิเนียมออกไซด์ (Al 2O 3 ) บางทีเรียกคอรันดัม มีความแข็งมากเกือบเท่าเพชร บางที่เรียก Emery บุษราคัม Sapphire ทับทิมก็เป็นพวกอะลูมิเนียมออกไซค์ที่ไม่บริสุทธิ์
15. สารส้ม ( Al 2O 3.14H 2O) ใช้แกว่งน้ำให้ตะกอนตกลงก้นตุ่ม
16. เกาลิน หรือ ดินขาว ( H 4 Al 2 Si 2 O 9 ) ใช้ประโยชน์คือ เอาทำเครื่องเคลือบดินเผา
17. เหล็ก ( Fe ) เป็นธาตุที่มีมากเป็นที 4 ในโลก ซึ่งเหล็กนี้ได้จากการถลุงเหล็ก โดยใช้เตาบลาสเฟอร์เนส (Blast Furnace ) เหล็กที่ได้มาจาก Blast Furnace เป็นเหล็กที่ไม่บริสุทธิ์เรียก Pigiron
18. เหล็กกล้า เป็นเหล็กที่ใช้ประโยชน์มาก เช่น ทำขัน ทำขบวนรถไฟ
19. เหล็กกล้าผสม คุณสมบัติและประโยชน์ที่เหล็กกล้าถูกสารอื่นผสม ดังนี้
- เติมโครเมียม ( Cr ) ทำให้เหล็กเหนียว แข็ง ใช้ทำมีดโกน เกียร์รถยนต์ เหล็กกล้ากันสนิม (Stainless Steel )
- เติมนิเกิล ( Ni ) ทำให้เหล็กเหนี่ยวไม่เปราะ ใช้ทำชิ้นส่วนรถยนต์
- เติมแมงกานีส ( Mn )ทำให้เหล็กแข็งและเหนียวใช้ทำตู้นิรภัยชิ้นส่วนเรือรบ
- เติมทังสเตน ( W ) ทำให้เหล็กเหนียว ใช้ทำชิ้นส่วนรถยนต์
20. ทองแดง ( Cu ) ซึ่งพบมากในธรรมชาติเกิดในรูปของสินแร่ต่างๆ และมีอยู่ในเลือดของสัตว์บางชนิด คือ มีใน Haemocyanin (ฮีมี)ทองแดงมีคุณสมบัติเป็นโลหะ เป็นตัวนำไฟฟ้าที่ดีมากลงมาจากเงิน
21. ทองเหลือง ( Brass ) คือ ทองแดงผสมกับสังกะสี ใช้ทำกุญแจ ปลอกกระสุนปืน กรอบประตู
22. บรอนซ์ ( Bronze ) บางทีเรียกสัมฤทธิ์ ลงหินหรือทองม้าล่อ คือ ทองแดงผสมกับดีบุก ในอัตราส่วนต่างๆ
23. จุนสี เป็นสารประกอบที่สำคัญของทองแดง บางทีเรียก Blue Vitriol มนุษย์ใช้จุนสีฆ่าเห็ดรา (Fungicide ) ฆ่าเชื้อโรคจัดเป็นพวกยาประเภท Germicide
24. เงิน ( Ag ) เป็นสื่อไฟฟ้าและความร้อนที่ดีที่สุด ทนทานต่อการกัดกร่อนของกรดอินทรีย์ และโซดาไฟ
25. ทองคำ ( Au ) เป็นธาตุที่หายากมาก มีในโลกประมาณ 1 เท่าของเงิน ความบริสุทธิ์ของทองคำใช้วัดเป็นกะรัต ทองคำที่บริสุทธิ์จริงคือ ทองคำ 24 กะรัต ทองคำนี้ใช้ทำทองขาวเทียม (White gold ) ซึ่งมีสีคล้ายทองขาว ประกอบด้วยทอง 80 % นิกเกิล 20%
26. โคบอลท์ ( Co ) โลหะนี้ผสมกับเหล็กกล้าเพื่อใช้เป็นเครื่องมือตัดโลหะ ประโยชน์สำคัญมากใช้ทำโคบอลท์ 60 เพื่อการรักษามะเร็ง
27. ทังสเตน ( W ) ปัจจุบันใช้ทำไส้หลอดไฟฟ้า ใช้ผสมกับเหล็กใช้ทำ Tungsten carbide ซึ่งจัดว่าเป็นสารที่แข็งมาก ใช้ประกอบเครื่องมือตัดโลหะด้วยความเร็วสูง
28. เยอรเมเนียม ( Ge ) เป็นธาตุที่หายากมาก ใช้เป็นส่วนประกอบ ของเครื่องทรานซิสเตอร์ และใช้ในเครื่องอิเล็กทรอนิกส์ต่างๆ